DOPLŇKY / MEDIKACE
Antikoagulační terapie
Vloženo 23.10.2019 , poslední aktualizace 9.12.2023
Obsah
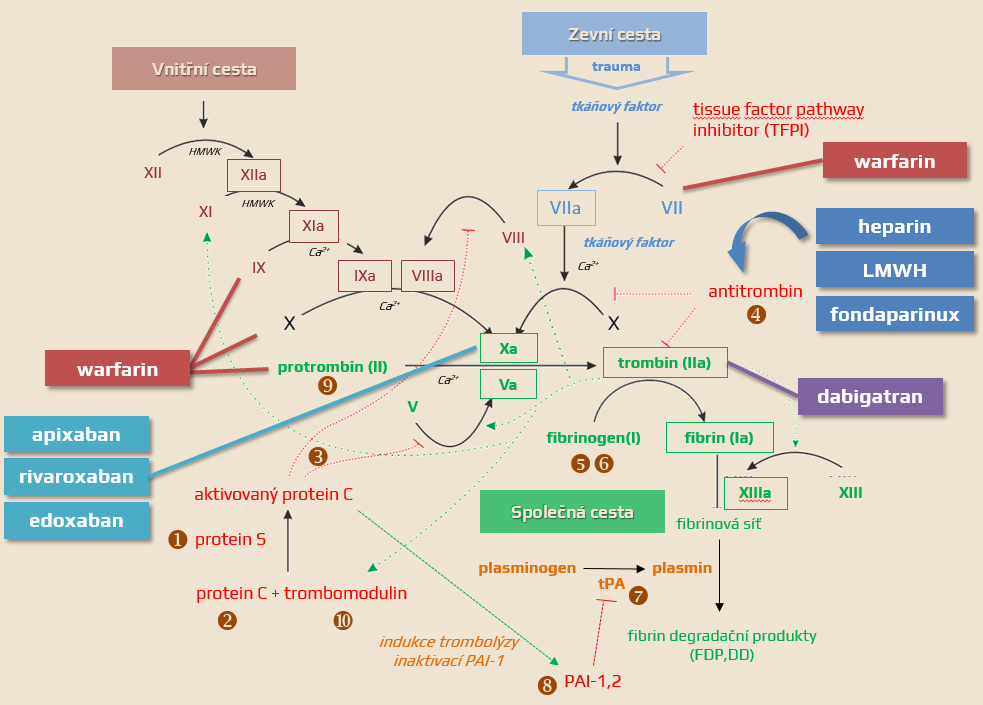
Rozdělení antikoagulancií
| Přímá antikoagulancia Inaktivují samotné koagulační faktory přítomné v plazmě |
Nepřímá antikoagulancia Ovlivňují koagulační faktory snížením jejich tvorby v játrech. |
|
| Přímé inhibitory trombinu/faktoru Xa Váží se na trombin / faktor Xa a tím blokují jejich funkci |
Nepřímé inhibitory trombinu/faktoru Xa Působí prostřednictvím aktivace antitrombinu (AT III) |
|
|
|
|
|
||
|
||
Indikace k antikoagulační terapii
- při rozhodování o nasazení antikoagulační léčby je třeba vycházet z individuálního posouzení rizika trombembolie a rizika krvácení.
riziko ischemie
CHA2DS2VAsc score
spontánní echokontrast
trombus v síni

riziko krvácení
HAS-BLED
ABC
ORBIS
HEMORR2HAGES
microbleeds
Obsah dostupný pouze pro přihlášené předplatitele.
- vyšší věk ani hemoragická transformace ischemie nejsou jednoznačnou kontraindikací následné antikoagulace
- riziko ICH
- VKA – 0.3-0.6% /rok
- DOAC – 0.1-0.2% /rok
- kontraindikací není s ohledem na risk/benefit ani zvýšené riziko pádů u starších pacientů (AAN guidelines 2014)
- u pacientů s CHADS2 ≥2 je warfarin bezpečnější než ASA nebo žádná terapie i při zvýšeném riziku pádů
- starší pacienti s rizikem iktu >2%/ročně by museli spadnout víc jak 300x ročně, aby warfarin nebyl považován za optimální léčbu [Garwood, 2008]
- u pacientů s vysokým rizikem krvácení vč ICH jsou alternativou k warfarinu nová perorální antikoagulancia (DOAC) , aspirin odpovídající alternativou není
- u pacientů se zvýšeným rizikem GIT krvácení je mezi DOAC preferován apixaban
Obsah dostupný pouze pro přihlášené předplatitele.
-
Studie WARSS (Warfarin Aspirin Recurrent Stroke Study) srovnávala účinnost warfarinu s cílovým INR 1.4-2.8 oproti ASA v dávce 325 mg. Randomizováno bylo 2206 pacientů s nekardioembolickým iktem. Tato studie neprokázala vyšší účinnost warfarinu oproti aspirinu v prevenci recidivy iktu a smrti (17.8 % vs. 16 %), ani výskyt hemoragických komplikací se v obou skupinách signifikantně nelišil (2.2 % warfarin vs 1.5 % aspirin). Efekt nebyl prokázán ani v podskupině pacientů po mozkovém infarktu s prokázanou stenózou či okluzí některé z velkých tepen
- ve studii WASID (Warfarin-Aspirin Symptomatic Intracranial Disease Study) byla testována účinnost warfarinu s cílovým INR 2-3 oproti aspirinu u pacientů s angiograficky prokázanou symptomatickou intrakraniální stenózou větší jak 50 %. Studie byla předčasně ukončena z bezpečnostních důvodů pro velký výskyt krvácivých komplikací ve skupině pacientů léčených antikoagulancii. Primárního výstupního kritéria bylo dosaženo v obou větvích přibližně u 22 % pacientů
- studie ESPRIT (European/Australasian Stroke Prevention in Reversible Ischaemia Trial) srovnávala účinnost warfarinu s INR 2-3 (n=536) oproti 30-325 mg aspirinu (n=532) v sekundární prevenci u pacientů s TIA či mozkovým infarktem s předpokládaným arteriálním původem. Primárním výstupním kritériem byla smrt z vaskulárních příčin, nefatální iktus, nefatální infarkt myokardu, závažné krvácivé komplikace. Průměrná doba sledování byla 4.6 roku. Primárního výstupního kritéria dosáhlo 19 % pacientů na antikoagulační terapii a 18 % na aspirinu. Vyšší účinnost antikoagulační terapie oproti aspirinu v prevenci ischemických příhod (závažné ischemické příhody 62 vs 84) byla neutralizována vyšším výskytem závažnějších krvácení (45 vs 18)
Monitorace u antikoagulační léčby
Při každé kontrole pacienta na antikoagulační terapii zjišťovat:
- Adherence – compliance + opakovaná edukace každou návštěvu
- ev. switch z warfarinu na DOAC při kolísajícím INR je podmíněn dobrou adherencí (vynechání jedné dávky DOAC má větší dopad než vynechání dávky warfarinu)
- opakovaně poučovat o správném uživání léku, nutnosti nosit rozpis medikace a kartičku týkající se antikoagulační terapie
- Bleeding risk assessment (každá návštěva)
- opakovaně HAS-BLED score
- pátrat po krvacivých komplikacích
- ev. nasadit PPI
- posoudit ev. nutnost redukce dávky nebo záměny AK
- Creatinine clearance (dle Cockcrofta-Gaulta)
- sledování ledvinných funkcí, ev. úprava dávky u DOAC
- á 12 měsíců u zdravých pacientů < 75 let
- á 6 měsíců (věk ≥ 75 let nebo fragilní)
- interval CrlCl/10 měsíců při CrCl < 60 ml/min
- Drug interaction – ověřovat lékové interakce, ev. úprava dávky
- léky zvyšující riziko krvácení (např. antirevmatika, verapamil u dabigatranu apod)
- Examination a ostatní
- sledovat TK, hmotnost (krajní hodnoty)
- pátrat po rizikových faktorech krvácení
- byly známky ev. trombembolie?
- vyskytly se nežádoucí účinky?
- odběry mimo ClCr:
- minimálně 1x ročně, v individuálních případech častěji
- minimálně KO, ledvinné a jaterní testy
- ev. specifické testy k ověření účinku
- sledovat TK, hmotnost (krajní hodnoty)
Antikoagulační terapie a renální funkce
- specifickou skupinu představují nemocní s renální insuficiencí
- klasifikace chronického onemocnění ledvin (Chronic Kidney Disease – CKD) dělí nemocné na základě glomerulární filtrace do 5ti skupin
Obsah dostupný pouze pro přihlášené předplatitele.
Antikoagulační terapie a malignita
- nádory i jejich léčba mohou vyvolat fisi, současně jsou nádory spojeny s vyšším rizikem trombózy i krvácení
- rozhodnutí o použití antikoagulancií u pacientů s nádorovým onemocněním by mělo být vysoce individuální a mělo by zohledňovat typ a stadium nádorového onemocnění, riziko trombózy a krvácení, preference pacienta a celkovou prognózu
- LMWH je optimální léčba pro pacienty s žilní tromboembolií (VTE) související s nádorovým onemocněním a profylaxe VTE (Mullard, 2014)
- důkazy o efektivitě dlouhodobého podávání LMWH např. u pacientů s fisi a malignitou chybí
- zkušenosti s DOACs v prevenci cévní mozkové příhody u pacientů s malignitou jsou omezené (malignita byla ve většině studií vylučovacím kritériem)
- menší práce s žilní trombózou ukázaly lepší účinnost DOAC oproti VKA a LMWH; metaanalýza randomizovaných studií však naznačuje vyšší riziko krvácení (O´Connell, 2020)
- analýza dat studie ARISTOTLE nicméně prokázala vyšší účinnost a bezpečnost apixabanu oproti VKA
Antikoagulační terapie a gravidita/laktace
Gravidita
- warfarin přechází přes placentu – může vést ke krvácení plodu či teratogenicitě (hlavně v 1.trimestru) – kontraindikován
- nejvyšší riziko teratogenicity je v 6-12. týdnu
- preferovány jsou LMWH a heparin (UFH)
- nepřecházejí přes placentu
- užívání spojeno s rizikem:
- krvácení z uteroplacentrání junkce
-
heparinem indukované trombocytopenie (HIT): 3% (méně u LMWH)
-
heparinem indukované osteoporózy: 2-3% (méně LMWH)
- pokud dojde na heparinu k HIT a je třeba pokračovat v antikoagulační terapii, je alternativou danaparoid sodium (ORGARAN), který neprochází placentou a má nižší potenciál k tvorbě HIT oproti LMWH [Bates, 2008]
- DOAC (údaje SUKL) – dabigatran a rivaroxaba jsou přímo kontraindikovány, apixaban není doporučen
- dabigatran
- reprodukční toxicita na zvířatech, ženy ve fertilním věku se během léčby přípravkem Pradaxa musí vyhnout otěhotnění
- nesmí být podáván během těhotenství, pokud to není zcela nezbytné
- apixaban
- studie na zvířatech neprokázaly škodlivé účinky, pokud jde o reprodukční toxicitu
- podávání apixabanu v těhotenství se z preventivních důvodů nedoporučuje
- rivaroxaban
- studie na zvířatech prokázaly reprodukční toxicitu + rivaroxaban prochází placentou ⇒ rivaroxaban kontraindikován v těhotenství
- ženy ve fertilním věku musí během léčby rivaroxabanem zabránit otěhotnění
- dabigatran
Laktace
- LMWH jsou zlatým standardem během kojení, protože nepřechází do mateřského mléka
- warfarin a UFH nepřecházejí do mléka a mohou být během kojení bezpečně použity (AHA/ASA 2014 IIa/C)
- DOACs – bezpečnost a účinnost u kojících žen nebyly stanoveny, podání je kontraindikováno
