ISCHEMICKÉ CMP / KLASIFIKACE A ETIOPATOGENEZE
Neurosarkoidóza
Poslední aktualizace 03.03.2024
Obsah
- sarkoidóza je multisystémové granulomatózní onemocnění neznámé etiologie, které obvykle postihuje mladší lidi (nejčastěji ve věku 25-50 let), častěji ženy
- neurosarkoidóza = projev sarkoidózy v centrálním nervovém systému
- postižení nervového systému je označováno jako neurosarkoidóza ( ~ 5%)
- vzácné, ale závažné onemocnění (~ 5-10 % případů); prevalence se v literatuře liší, některé případy mohou být asymptomatické nebo oligosymptomatické
- většinou doprovázena systémovými příznaky a nitrohrudním postižením
- izolované postižení nervového systému je vzácné [Hodge, 2007]
- diagnstika je náročná; je postavena na kombinaci klinického obrazu, zobrazovacích vyšetření, a histologii
Patogeneze
- přesná příčina sarkoidózy není známa.
předpokládá se, že jde o aberantní imunitní reakci na neznámouz noxu u geneticky predisponovaného jedince; vzniká oligoklonální buněčná odpověď s typickou akumulací CD4+ Th1 lymfocytů a aktivovaných makrofágů v místě postižení - histologicky se u neurosarkoidosy jedná o tvorbu granulomů v CNS
- léze obsahují T lymfocyty, makrofágy a epiteloidní buňky
- sarkoidóza bývá spojena se zvýšenou syntézou ACE (angiotenzin konvertující enzym) a 1,25-dihydroxycholekalciferolu s následnou hyperkalcemií a hyperkalciurií
- dále bývá zvýšený imunoregulační index v tekutině z bronchoalveolární laváže
- odráží nerovnováhu mezi pomocnými (CD4+) a supresorovými (CD8+) T-lymfocyty a obvykle vykazuje zvýšený poměr CD4+/CD8+
Cévní postižení u neurosarkoidózy
- typickým projevem neurosarkoidózy je spíše progresivní encefalopatie než mozková příhoda [Brown,1989]
- nicméně byly publikovány kazuistiky popisující kombinaci neurosarkoidózy a CMP [Corse, 1990] [Nakagaki, 2004] [Hodge, 2007]
- na vzniku CMP se mohou podílet různé mechanismy:
- arteriolopatie v důsledku perivaskulárního granulomatózního zánětu
- kardioembolizace při kardiomyopatii či arytmiích
- komprese velkých tepen granulomy
- zánět stěny vělkých tepen s tvorbou trombů (arteritis)
- poruchy koagulace a fibrinolýzy [Hasday, 1988]
- trombóza splavů (⇒ žilní infarkt)
Klinický obraz
- postižení CNS se objevuje v 5-10% případů, většina z těchto nemocných vykazuje současné extracerebrální postižení
- klinicky dominují ložiskové příznaky, org. psychosyndrom, epi záchvaty
- při míšním postižení se většinou jedná o subakutní průběh, jsou typické dlouhé míšní T2 léze přes 3 segmenty s nepravidelným enhancementem, byly popsány ale i kratší multifokální léze bez enhancementu
- definitivní diagnóza sarkoidózy je stanovena na základě biopsie, která prokáže nekaseifikující granulomy
| Nejčastěji bývají postiženy: |
|
|
Nitrolební léze
Míšní léze
Periferní neuropatie (15%)
Myopatie
|
Diagnostika
Při multifokálním postižení nervového systému by se diferenciálně diagnosticky mělo vždy uvažovat o sarkoidóze.
CT / MR mozku a míchy
-
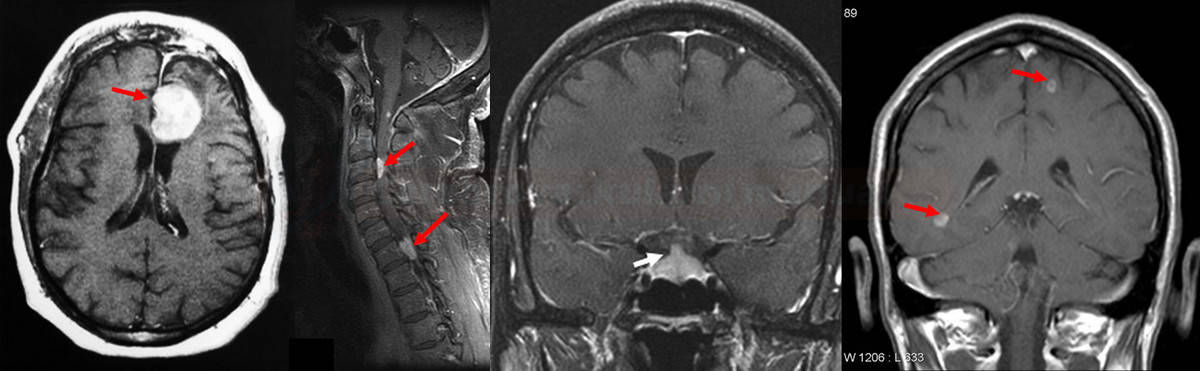
neurosarkoidóza může postihnout různé nervové struktury; preferovanou diagnostickou metodou je magnetická rezonance
- leptomeninální postižení je nejlépe patrné na MRI s kontrastem; enhancement může být nodulární nebo difuzní
-
parenchymové léze jsou nejlépe patrné na T2 obrazech
-
granulomy jsou hyperintenzivní v T2, často lokalizované v periventrikulární bílé hmotě, hypotalamu, hypofýze nebo mozkovém kmeni
-
jsou spíše malé, některé ale mohou mít až několik centimetrů v průměru
-
mohou se postkontrastně sytit
-
spinální granulomy mohou způsobit mass efekt v páteřním kanálu
-
- kraniální neuropatie (zejména n. VII a II)
- hydrocefalus v důsledku obstrukce likvorových cest granulomy
-
DWI může prokázat čerstvou ischemii
-
MR nálezy u neurosarkoidózy nejsou specifické a mohou napodobovat jiné stavy, jako je roztroušená skleróza, lymfom CNS nebo infekční meningitida; výsledky MRI musí být interpretovány společně s klinickými nálezy a dalšími diagnostickými testy.
Likvor
-
až ve 30% je likvorologický nález normální
- patologické nálezy:
-
lymfocytární pleocytóza
-
zvýšená hladina bílkovin
-
snížená hladina glukózy
-
pozitivní oligoklonální pásy
-
Zvýšená hladina ACE v séru a likvoru
- enzym konvertující angiotenzin (ACE) je produkován epiteloidními buňkami, které jsou součástí granulomů
- zvýšení menší jak dvojnásobek horního limitu normy není diagnostické
- při zvýšení nad dvojnásobek normy je diagnóza sarkoidózy pravděpodobná, ale nález není specifický (↑ u TBC, histoplazmózy, Crohna apod)
- hodnota sérového ACE je také ovlivněna polymorfismem genu pro tento enzym a není jej použít u pacientů léčených inhibitory ACE
Sérová hladina Ca a gamma globulinu
- hyperkalcinemie a hyperkalciurie je podmíněna nekontrolovanou konverzí 25-cholekalciferolu na 1,25-dihydroxycholekalciferol (kalcitriol – aktivní vitamin D3).
- ke konverzi dochází v epiteloidních buňkách granulomu, a proto se hladina vápníku normalizuje při terapii kortikosteroidy.
- častěji se projeví v letním období, kdy se vápník zvýšeně resorbuje střevem také při zevní aktivaci vitamínu D
- hypergamaglobulinemie bývá častým nálezem; obvykle je detekováno zvýšení hladsin IgG, IgA i IgM bez monoklonální gamapatie
- cirkulující imunokomplexy (CIK) bývají zvýšeny u akutní formy
RTG a HRCT plic
- přítomna intrathorakální hilová lymfadenopatie s predilekcí v horní a střední části plic
- léze jsou lokalizovány podél bronchovaskulárních svazků a lymfatických cév
- na rtg hrudníku se rozlišuje 5 stádií (Scaddingova klasifikace) (Scadding, 1961)
- stadium 0 – bez rentgenového průkazu intrathorakální sarkoidózy
- stadium 1 – oboustranná hilová lymfadenopatie bez postižení plicního parenchymu
- stadium 2 – oboustranná hilová lymfadenopatie + plicní infiltráty
- stadium 3 – plicní infiltráty bez hilové lymfadenopatie; onemocnění progreduje a postihuje plicní tkáň jizvením nebo granulomy, zatímco hilové lymfatické uzliny již nemusí být zvětšené
- stadium 4 – ireverzibilní plicní fibróza, která vede k narušení plicní architektury, ztrátě objemu a případně ke vzniku bul. Toto stadium je spojeno s významnou morbiditou a možností respiračního selhání
- v současnostri se spíše doporučuje HRCT hrudníku, protože nabízí lepší detekci abnormalit plicního parenchymu, dýchacích cest a také cévních struktur (Levy, 2018)
Biopsie
- definitivní diagnóza neurosarkoidózy je založena na histologickém potvrzení
- přímá biopsie mozku je méně častá s ohledem na rizika výkonu
- diagnózu neurosarkoidózy podpořit biopsie z přístupnějších tkání, která prokáže granulomatózní zánět
- transbronchiální biopsie (TBB) se upřednostňuje v případech plicního postižení
- bioptický materiál lze získat i z jiných míst (periferní uzliny, svaly, kůže)
- biopsie obvykle odhalí nekazeifikující granulomy tvořené shluky zánětlivých buněk bez centrální nekrózy; tyto granulomy jsou často obklopeny lemem lymfocytů a příležitostně fibrózou
- absence centrální nekrózy pomáhá odlišit sarkoidózu od jiných granulomatózních onemocnění, jako je tuberkulóza a plísňové infekce
PET/CT scan
- diagnostika mimoplicního postižení
- radioaktivní glukóza se vychytává v místech s aktivním zánětem (plíce, lymfatické uzliny, slinné a slzné žlázy, srdce, játra, slezina apod.).
- nedokáže jednoznačně odlišit sarkoidózu a lymfom
Diagnostická kritéria
|
Diagnóza neurosarkoidózy je:
|
možná
|
|
pravědpodobná
|
|
definitivní
|
Terapie
- jasná indikace k léčbě :
- hyperkalciurie (hyperkalcémie)
- závažné orgánové léze (neurosarkoidóza, sarkoidóza srdce, oční formy nereagující na lokální terapii, zadní uveitida a neuritida optiku, torpidní kožní léze nebo postižení jiných orgánů)
- léčba plicního postižení je vzhledem k různorodosti stadií a možné spontánní reverzibilitě značně diskutabilní
- ke spontánní remisi dochází u 55–90 % pacientů stadia I, u 40–70 % ve stadiu II a u 10–20 % ve stadiu III.
- dle většiny doporučení nejsou léčeny plicní formy s lehkou (až středně těžkou) poruchou plicních funkcí bez klinických příznaků
- léčeni jsou sympt. pacienti
Kortikoidy
- startovací dávka PREDNISON 20–40 mg /d
- při přidání jiných léků s kortikosteroidy šetřícím účinkem (methotrexát, azathioprin a jiné níže uvedené) lze dávku kortikoidů snížit
- efekt léčby se předpokládá během prvních 6 týdnů a vyhodnocuje se po 3–6 měsících.
- při efektu se pomalu snižuje dávka na 5–10 mg/d a pokračuje se celkem 6–12 měsíců
- při těžkém průběhu pulsní léčba – SOLUMEDROL 0,5-1g/d po dobu 3 dnů
Imunosupresiva
- pokud nedojte k udržení remise při snížení prednisonu < 10 mg/d, jsou indikováni k terapii léky šetřící kortikoidy.
- metotrexát 10 mg/týden 3-6 měsíců u rezistentních forem onemocnění, často v kombinaci s kortikoidy
- IMURAN (azathioprin) 2-2.5mg/kg/d 3-9 měsíců
- při postižení CNS dávka 150 mg/d
- v rámci experimentální léčby cyklosporin A, mykofenolát mofetil, takrolim, tyto léky se podávají spolu s kortikoidy jako kortikoidy šetřící látky nebo samostatně při intoleranci kortikoidů
Antimalarika
- PLAQUENIL (hydroxychlorochin) 200-400mg/d – zvláště u pacientů s hyperkalcemií, kožním a neurologickým postižením